动脉硬化是导致心脑血管疾病的核心病理基础,全球每3例死亡中就有1例与其相关。这种看似缓慢进展的疾病,可能在某个清晨以心肌梗死或脑卒中的形式突然发作,其沉默的杀伤力令人生畏。及时了解防治要点,掌握科学用药策略,是抵御这场无声战争的关键。

动脉硬化的本质是血管壁脂质沉积引发的慢性炎症反应。当低密度脂蛋白胆固醇(LDL-C)渗入血管内膜,被氧化修饰后触发免疫反应,形成由泡沫细胞构成的"小米粥样"斑块。这些斑块如同定时,表面纤维帽破裂时,会引发血小板聚集形成血栓,导致血管急性闭塞。
危险信号识别:
特殊群体需警惕:糖尿病患者可能无典型胸痛,仅表现为呼吸困难;老年女性常以乏力、恶心等非特异性症状起病。
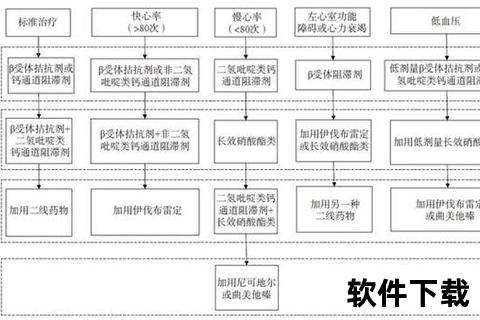
作用靶点:
通过抑制HMG-CoA还原酶,阻断肝脏胆固醇合成,使肝细胞表面LDL受体上调,加速血液中LDL-C清除。同时具有稳定斑块、抗血管内皮炎症等多重效应。
代表药物:
临床数据:
高强度他汀治疗可使LDL-C降低50%以上,斑块体积缩小2.6%-9.1%(ASTEROID研究)。但需警惕横纹肌溶解风险,用药期间需监测肌酸激酶。
双通路作用机制:
基因导向治疗:
约30%亚洲人群存在CYP2C19功能缺失基因,导致氯吡格雷抵抗。基因检测指导下,可换用替格瑞洛(直接活性药物,无需代谢激活)或调整剂量。
出血风险管理:
消化道出血高危患者建议联用质子泵抑制剂,但需避免奥美拉唑(影响氯吡格雷代谢),优选泮托拉唑。
辨证用药原则:
循证证据:
CTS-AMI研究显示,通心络联合标准治疗可降低30天主要不良心血管事件风险36%。
一级预防:
每日摄入膳食纤维≥25g(如燕麦、奇亚籽),可结合胆汁酸排出胆固醇。每周150分钟中等强度运动(心率达到[170-年龄]次/分)可提升HDL-C 5%-10%。
二级预防:
确诊患者需每3个月检测颈动脉超声,监测斑块稳定性。Lp(a)>50mg/dL提示遗传风险,需强化降脂。
三级康复:
心脏康复计划包括有氧训练(如踏车试验评估后的步行训练)、阻抗训练(弹力带抗阻)、呼吸训练(腹式呼吸法),可降低再梗死风险28%。
这场与动脉硬化的持久战中,每个人都是自己健康的第一责任人。从今天开始,用一片药物的严谨服用、一次运动的坚持完成、一份饮食的智慧选择,构筑起守护生命的铜墙铁壁。当医学智慧与个体行动形成共振,血管衰老的时钟必将被重新拨动。