当一位癌症晚期患者因剧痛彻夜难眠时,医生为他注射的能在15分钟内让疼痛消散;但另一位长期使用止痛的年轻人,却因成瘾陷入戒断反应的深渊——这种药物为何既能救人于水火,又能将人拖入泥潭?
1. 中枢神经系统的精密调控
的镇痛机制始于大脑与脊髓的协同作用。研究发现,通过激活μ型受体,模拟人体天然镇痛物质内啡肽的功能,抑制疼痛信号传递的关键物质P物质释放。脊髓背角作为痛觉传入的“第一道关卡”,能在此阻断神经冲动的上行传递,如同给疼痛信息装上过滤网。
在脑干腹内侧延髓(RVM),特定神经元集群(如RVMBDNF神经元)构成“镇痛总控台”。2024年《Science》研究揭示,激活这些神经元可增强脊髓抑制性神经元的活性,显著减轻机械性疼痛。这种从脑干到脊髓的多级调控网络,使得能精准作用于不同疼痛类型。
2. 外周与内脏的同步干预
除了中枢作用,还通过调节平滑肌张力缓解内脏绞痛。例如降低肠道蠕动缓解腹泻,抑制胆囊收缩缓解胆绞痛。但这种广泛作用也带来便秘、尿潴留等副作用,需在用药时密切监测。

1. 神经可塑性的黑暗面
复旦大学团队研究发现,会协同激活大脑皮层两类中间神经元,导致抑制性环路持续失活。这种神经可塑性改变使得多巴胺能奖赏通路异常活跃,形成“用药-愉悦-渴求”的恶性循环。当内源性肽分泌被长期抑制,机体逐渐产生药物依赖。
2. 耐受与戒断的生物学基础
持续用药使受体下调,患者需不断增加剂量才能维持镇痛效果。突然停药时,去甲肾上腺素能系统反跳性亢进,引发焦虑、出汗、腹泻等戒断症状。动物实验显示,这种改变与腹内侧前额叶皮层的表观遗传调控密切相关。
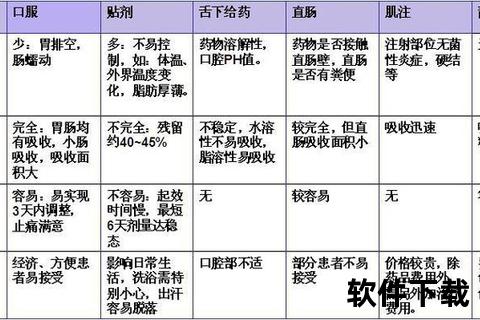
1. 严格分级使用
2. 个体化剂量调整
3. 成瘾预警信号识别
| 行为表现 | 生理指标 |
|-|-|
| 自行增加剂量 | 瞳孔持续缩小 |
| 多途径获取药物 | 呼吸频率<12次/分 |
4. 特殊人群防护
5. 多模式镇痛策略
mermaid
graph LR
A[神经阻滞] --> B(物理治疗)
C[非甾体抗炎药] --> D{疼痛缓解}
E[心理干预] --> D
F[微量] --> D
6. 科学戒断方案
采用替代递减法,配合认知行为治疗,可使戒断成功率提升至65%。最新研究显示,组蛋白去乙酰化酶抑制剂可能成为防复吸的新方向。
基因检测技术已能识别OPRM1基因多态性,预测个体成瘾风险。纳米载药系统可实现的定向缓释,减少中枢暴露量。2024年发现的RVM-脊髓回路特异性调控机制,为开发非成瘾性镇痛药提供了新靶点。
行动指南
(本文不构成医疗建议,具体用药请遵医嘱)