阿莫西林作为广谱抗生素家族中的重要成员,其胶囊剂型的制备工艺直接影响药物的疗效与安全性。一粒看似普通的胶囊,背后需要经历原料筛选、颗粒成型、稳定性控制等十余项关键技术环节,任何细微偏差都可能导致药效波动甚至安全隐患。本文将从科学视角解析这一过程的核心步骤,并探讨如何通过工艺优化确保药物质量。
阿莫西林胶囊的制备始于原料药与辅料的黄金配比。原料药需符合《中国药典》对纯度(≥90%)、水分(≤5%)、重金属(≤10ppm)等指标的严苛要求。辅料体系中,玉米淀粉作为填充剂可调节药物释放速度,硬脂酸镁作为润滑剂能减少生产过程中的机械阻力,羧甲淀粉钠则通过吸水膨胀特性增强崩解效率。
在混合工序中,三维运动混合机的转速需恒定在5转/分钟,混合时间严格控制在120分钟以内。研究显示,超过此时限会导致颗粒间静电吸附加剧,影响后续填充均匀性。混合后的物料需经过三次元振动筛分级,理想颗粒分布为:20目筛留存物占87%,60目筛留存物13%,80目筛不得有残留物——这种粒径组合既能保证流动性,又可避免细粉导致的装量偏差。

胶囊装量差异是质量控制的核心指标。7500型全自动填充机的计量盘选择直接影响精度,2号计量盘因其特殊的腔体设计,可将装量波动控制在±5%以内,显著优于其他型号的±7%误差。环境湿度调控更是关键,当相对湿度超过60%时,阿莫西林颗粒吸湿结块风险增加3.2倍;而低于40%则易产生静电吸附,最佳湿度区间应维持在45%-55%。
水分子对药物稳定性的影响呈现双面性:原料药中的结晶水含量需保持在三水合物形态,失水率超过1.5%会引发闭环二聚体杂质生成,该杂质与过敏反应发生率呈正相关。生产过程中采用真空低温干燥技术(30℃以下),配合在线水分监测系统,可将水分活度精准控制在0.35-0.45之间,有效抑制降解反应。
对于儿童患者,制备时需特别注意辅料选择。滑石粉用量需严格控制在0.4%以下,过量可能引发肠道刺激;孕妇用胶囊则应避免使用交联聚乙烯吡咯烷酮,因其代谢产物存在致畸风险。老年患者由于胃酸分泌减少,处方中需增加5%-8%的肠溶材料,确保药物在小肠段精准释放。
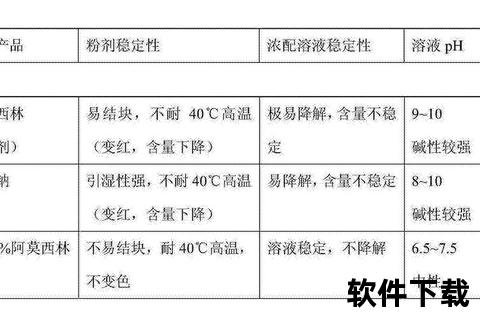
稳定性实验数据显示,未添加抗氧化剂的胶囊在40℃/75%RH条件下储存3个月后,杂质总量从0.8%激增至2.3%,主要降解产物为阿莫西林噻唑酸。而添加0.1%维生素E作为稳定剂的样品,同等条件下杂质增幅仅为0.3%。这提示合理使用辅料可大幅提升药品货架期稳定性。
1. 存储要点
2. 服用警示
3. 工艺识别技巧
优质胶囊的鉴别特征包括:内容物呈均质粉末(无可见结晶)、60秒内完全崩解、批号激光刻印清晰。若发现胶囊壳有粘连或内容物结块,提示可能存储条件不当或生产工艺缺陷。
微流控技术的引入正在革新传统工艺。新型微囊化设备可制备粒径50-80μm的载药微粒,使血药浓度波动范围从传统工艺的±35%缩小至±12%。3D打印胶囊壳技术则能实现胃溶层与肠溶层的精准叠加,使药物在特定肠道段释放度提升至98%。
在质量控制领域,近红外光谱(NIRS)在线监测系统已实现装量差异的实时反馈,配合机器学习算法,可将不合格品检出率从人工抽检的85%提升至99.7%。这些创新技术正在推动抗生素制剂向精准化、智能化方向发展。
行动建议
通过理解这些制备细节,患者能更科学地评估药品质量,医护人员可针对性指导用药,而行业从业者则能把握技术升级方向。药物制备的每个微小改进,最终都转化为对生命健康的更坚实守护。